Oggi fa troppo caldo per leggere e per scrivere, quindi l’articolo di oggi su Ziopharm Oncology sarà breve e rinfrescante. Come ricorderete se avete letto gli articoli precedenti la strategia di investimento che avevo impostato riguardo Ziopharm era attendere il fallimento della fase 3 di palifosfamide nel trattamento dei sarcomi e puntare, dopo che la quotazione fosse scesa notevolmente, sul resto della pipeline, quella di Intrexon, per capirci. Tutto è andato secondo i piani, il titolo è crollato arrivando a gravitare nella zona fra gli 1,5 e i 2$ e li è scattato l’acquisto. Quello che è successo poi lo potete vedere (se non ne siete stati testimoni diretti) nell’immagine qui sotto.
Mi sono permesso di evidenziare il movimento pre-ASCO che ha portato il titolo dalla zona 1,75$ fino a sfiorare i 3$. Poi c’è stata la presentazione dei dati di Ad-RTS-IL-12 nel trattamento del melanoma ad ASCO e la quotazione è rientrata nei ranghi. Cosa è successo in quei giorni?
Il 16 maggio Ziopharm presenta dati aggiornati rispetto a quelli che lo scorso ottobre avevano destato attenzione fra gli investitori:
Study subjects (n=14) were treated in four dose cohorts of the activator ligand. Compelling clinical activity was observed in five of seven (71 percent) patients dosed at the two highest dose levels. These five patients experienced prominent inflammatory responses in injected and non-injected lesions and transient increases then decreases in the size of injected and non-injected lesions. Clinical activity in these higher dose cohorts coincided with the highest serum levels of IL-12 and IFN-γ, including a four-fold median increase from baseline at peak levels compared with lower dose cohorts. Flow cytometric analyses of peripheral blood mononuclear cell (PBMC) samples also revealed seven-fold and four-fold median increases from baseline at peak levels in absolute CD3+ and CD8+ T cell values, respectively, compared with lower dose cohorts. The most common related adverse events (AEs) included fever, nausea, vomiting, fatigue and arthralgia. One death occurred in the study, unrelated to treatment, due to septicemia secondary to cellulitis and colitis.
Il grassetto è mio. Ad ASCO la sorpresa, nessuna risposta fra i pazienti trattati, ma il comunicato recita così:
For the study, Ad-RTS-IL-12, an adenoviral vector engineered to express IL‑12 utilizing the RheoSwitch Therapeutic System® (RTS®) technology, was injected intratumorally in patients with advanced melanoma (n=14). Expression of IL-12 was controlled through the administration of an oral activator ligand (INXN‑1001), which was administered in four ascending dose cohorts. The Company previously reported that compelling clinical activity was observed in five of seven (71 percent) patients dosed at the two highest dose levels (Nemunaitis et al. ASGCT 2013). The study further demonstrated that treatment with Ad-RTS-IL-12 + INXN-1001 was shown to increase intratumoral IL-12 mRNA transcription. The mRNA level was very tightly controlled (on and off) by the biologic switch and oral activator ligand. Consequent on the increase in IL-12 expression there was a major increase in tumor-infiltrating lymphocytes (CD8+, CD45RO+) in the tumor microenvironment as measured in tumor biopsies. Subsequently clinical activity was observed in injected and non-injected lesions, primarily at the higher doses of INXN-1001 (100 and 160 mg), with inflammation, shrinkage, flattening, and depigmentation of lesions correlated with the highest serum levels of IFN-γ.
Bene, senza andare a controllare il poster non sembra che le due comunicazioni dicano qualcosa di molto diverso l’una dall’altra. Vediamo anche quella di ottobre:
Initiation of the Phase 2 study follows the successful, dose-escalation Phase 1 study in which clinical activity was observed in 5 of 7 (71%) patients dosed at the two highest dose levels. The data also showed a correlation between T-cell immune responses and clinical outcome, with no dose-limiting toxicities reported. A total of 13 patients were enrolled in the Phase 1 study, and were treated with a range of doses of an orally administered activator ligand. Three serious adverse events (SAE) were reported: two related to therapy (pyrexia and cytopenia), and one unrelated (deep vein thrombosis). Unrelated to the study therapy, one patient death was reported due to bacterial sepsis and progression of disease. The Company expects to submit full results of the study for presentation at a major medical meeting.
Mentre le prime due notizie sono reperibili sul sito Intrexon, l’ultima che vi ho messo, ossia la prima in ordine cronologico la trovate solo sul sito di Ziopharm. Leviamoci dalla testa il comunicatostampa riguardo ASCO, se in due occasioni si parla di attività clinica in 5 pazienti su 7, mi sembra un filino assurdo aspettarsi qualche tipo di risposta, completa o parziale che sia. Se Ziopharm avesse avuto qualche paziente nel quale si fosse manifestata una qualsiasi forma di risposta, lo avrebbe detto fin da subito e gli aggiornamenti sarebbero stati sulla durata delle risposte. Oggi sappiamo che al dosaggio di 160 mg un paziente ha ottenuto una stabilizzazione della malattia per oltre 20 settimane. Sappiamo che l’attività si è registrata nei dosaggi da 100 e 160 mg e non nei due inferiori e che coincide con livelli di IL-12 e IFN-γ nel plasma quattro volte superiori a quelli registrati nei dosaggi più bassi. Sappiamo che dove c’è stata attività si sono registrati valori 7 volte maggiori di cellule CD3+ e CD8+ rispetto alla baseline. Quanto ci dice questo riguardo il farmaco?
Per prima cosa quanto visto da Ziopharm, la chiamo così anche se sarebbe più opportuno dire Intrexon, ha spinto la compagnia ad iniziare subito una fase 2. Per secondo, si è stabilita una correlazione fra il dosaggio del farmaco e l’attività, si è stabilita una certa influenza sul sistema immunitario del paziente e ciò si traduce in un effetto sia sul restringimento delle lesioni che sul dolore provocato da esse anche in zone distanti dall’iniezione intratumorale. Tutto questo è coerente con l’ipotesi di utilizzo del farmaco di Ziopharm che vado brevemente a riassumere, a beneficio di coloro i quali non conoscano Ad-RTS IL-12 e la piattaforma di Intrexon.
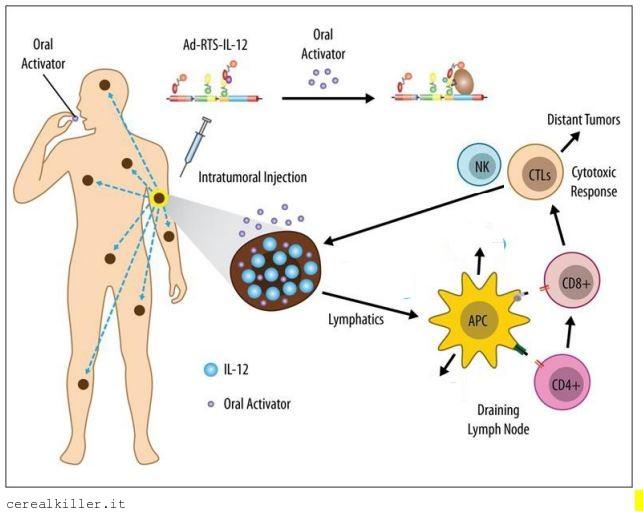
In poche parole Ziopharm va a somministrare IL-12, interleuchina 12, al paziente per via intratumorale, cioè con una iniezione in una delle lesioni causate dal tumore. L’interleuchina 12 è un potente anti tumorale ma che ha nella tossicità il principale limite nell’impiego su esseri umani. Intrexon ha sviluppato una tecnologia per cui la cito-tossina viene attivata da una pillola, in modo da controllare le reazioni avverse. Date uno sguardo all’immagine:
Ora, la stimolazione delle difese immunitarie del paziente è fondamentale, sia per quanto riguarda le lesioni distanti dal luogo di infusione del farmaco sia per la durata delle risposte. Il sistema immunitario deve avere una memoria. Queste sono le prerogative di vaccini anti-cancro come Allovectin di Vical (VICL) e sono ciò su cui si fondano immunoterapici come Yervoy. Se leggete questo blog sapete che non sono propriamente un fan di Allovectin e ritengo che la fase 3 in corso darà esito negativo, mentre (pur avendo molte riserve) per quanto riguarda Yervoy abbiamo la certezza che lo studio registrativo abbia dato buoni frutti.
Yervoy è un anticorpo anti CTLA-4 e, sebbene il futuro preveda l’impiego del farmaco in combo con un anticorpo anti-PD-1, rimane una delle più gettonate opzioni terapeutiche a disposizione dei malati. Yervoy è stato approvato in base agli effetti legati alla sopravvivenza, non al tasso di risposta (ORR). A dirla tutta i tassi fatti registrare dal farmaco di Bristol-Myers Squibb non sono stati entusiasmanti, se non in particolari condizioni. L’efficacia e la tollerabilità di Yervoy sono state testimoniate in uno studio randomizzato (3:1:1), in doppio cieco e doppio dummy su 676 pazienti con melanoma non resecabile o metastatico dopo la prima linea di trattamento. Del totale dei pazienti 403 hanno ricevuto Yervoy a 3mg/kg con un vaccino peptidico (GP100), 137 pazienti hanno ricevuto Yervoy a 3 mg/kg e 136 il solo vaccino. Lo studio ha arruolato pazienti con genotipo HLA-A2 0201, restrizione dovuta all’impiego del vaccino ed ha escluso pazienti con malattie autoimmuni o in fase di somministrazione di immunosoppressori. I dati relativi alla sopravvivenza:
Lo studio in questione ha subito 6 modifiche, se ben ricordo, e l’endpoint primario è passato dall’essere il tasso di risposta (ORR) al miglior tasso di risposta (BORR) fino alla conclusiva sopravvivenza globale (OS). A supporto di questa fase 3 sono stati portati sia in USA che in EU 7 altri studi nei quali l’obiettivo primario è stato quasi sempre il tasso di risposta migliore (BORR). La scelta di procedere con OS per la fase 3 è stata determinante.
Il concetto di risposta, se si parla di immunoterapia, può essere fuorviante.
Nel caso di questo studio la BORR è stata di 5,7% per Yervoy e GP100, 10,9% per Yervoy e 1,5% per GP100. Come vedete, non si tratta di numeri imponenti, ciononostante la sopravvivenza è stata di 10 mesi vs 6, il che indica che come surrogato il numero di risposte non è attendibile in certi casi.
Ziopharm ritiene che Ad-RTS IL-12 consenta di ottenere un tasso di controllo della malattia tale da giustificare una fase 2. Lo credo anche io, soprattutto se devo basarmi sui dati di Yervoy, in mancanza di dettagli sulla sopravvivenza e la durata delle risposte. Questo ultimo aspetto poi è cruciale: che senso ha ottenere una risposta se poi questa dura pochi giorni? Ha un valore maggiore rispetto ad una non-risposta? Evidentemente no. La durata delle risposte nella fase 3 di Yervoy è stata di oltre 11 mesi per il braccio con il vaccino, dato che non è semplice confrontare con le oltre 20 fatte registrare da un paziente con SD nel braccio al dosaggio più alto nello studio di Ziopharm, ma che non pone a sfavore di Ad-RTS IL-12 in ogni caso.
Ziopharm, in conclusione…
Dubito che il movimento che ha portato Ziopharm a sfiorare i 3$ a fine aggio fosse legato ad ASCO ed all’aggiornamento dei dati di Ad-RTS IL-12. Non ho una spiegazione legata alla pipeline e non oso spingermi troppo in la riguardo a congetture su movimenti finanziari o possibili scenari legati ad altre case farmaceutiche. Certo è che Randal Kirk i soldi li ha fatti proprio in questo modo, rivalutando compagnie farmaceutiche per poi rivendere a prezzi da capogiro. Il movimento fatto registrare dalla quotazione in quei giorni è sospetto, su questo non ho dubbi, ma mancando la spiegazione, l’unico approccio possibile è guardare avanti.
Ziopharm al 31 marzo aveva in cassa 55 milioni di dollari, soldi sufficienti a passare il 2013 in scioltezza, anche se l a mano sul fuoco non va messa per nessuno. Entro fine anno avremo un discreto numero di eventi binari a cui prestare attenzione, come i primi dati della fase 2 sul melanoma e di quella nel cancro al seno di Ad-RTS IL-12, oltre ai preclinici riferiti ad una prova di concetto in merito al trattamento del glioblastoma.
Se Ziopharm o, per meglio dire Intrexon, ha fiducia in Ad-RTS IL-12, attenderà questi dati prima di batter cassa, probabilmente ad una cifra ben superiore a quella attuale.
A quel punto dovrebbero già essere pronti per la seconda ondata targata Intrexon e le cose si faranno ancora più interessanti.



Ciao e grazie
ziopharm rientrato ieri sera a 2,12
oggi trovato questo ,http://www.4-traders.com/ZIOPHARM-ONCOLOGY-INC-33865/news/ZIOPHARM-Oncology-Inc-ZIOPHARM-Oncology-to-Present-at-the-8th-Annual-JMP-Securities-Heal
ciao a tutti