Dopo mesi e mesi di silenzio mi faccio vivo, come le tasse, come una fastidiosa malattia che non riesci a debellare ma, a differenza delle imposte, io non ti costo niente e a differenza di un virus intestinale io ti faccio correre meno velocemente al bagno. O almeno spero.
Non solo irrompo nella tua vita come un ladro nella notte ma prima di arrivare al punto per il quale mi sono palesato faccio giri di parole assurdi e scrivo frasi senza senso ed ecco perché, senza che nessuno me lo abbia chiesto, ti agevolo la lista delle domande che più spesso mi sento fare in qualità di amministratore di questo sito.
Alla posizione numero uno, l’immancabile: “Sei vivo?” o “Dove sei sparito?”
In seconda posizione un altro classico: “Che fine ha fatto il portafoglio Biotech?”
In terza posizione: “Che problemi hai? Hai battuto la testa da piccolo?”
Appena sotto il podio: “Perché insisti con Curis? Chi te lo fa fare?”
Al quinto posto abbiamo: “Che problemi hai? Perché insisti con Curis? Chi te lo fa fare? Hai battuto la testa da piccolo?”
Sullo sbattere la testa e su Curis.
Si, ho accumulato un certo numero di contusioni al capo: cadendo da alberi, almeno una bottigliata e, no, la bottiglia non si spacca come nei film ma fa tanto, tanto male. Alle medie ho smontato il corrimano in legno di una scala per giocare a hockey (lo so, non dire niente) ed un mio amico, non ricordo per quale motivo, ad un certo punto mi ha colpito giusto in fronte esultando poi come un vichingo mentre io giacevo inerme sulla moquette.
Questa è solo una piccola parte di quello che mi è capitato ma sei vuoi sapere qual è il miglior modo per sbattere la testa quando si è piccoli ti lascio il link in descrizione.
Sbatto la testa metaforicamente ogni volta in cui mi avvicino a Curis perché, diciamocelo, è un’azienda che nella sua storia ha saputo raggiungere l’approvazione di un solo prodotto e non l’ha nemmeno monetizzato come si deve. Ha continuato a promettere e non mantenere ma, nel suo eterno turlupinare ha premiato spesso gli azionisti che hanno saputo staccarsi dalle sue grinfie in tempo.
Ora Curis si ritrova con un solo assetto potenzialmente valido e alcuni studi già avviati. Non è a rischio reverse split perché lo ha fatto qualche mese fa, ha in cassa abbastanza pecunia per arrivare al 2025, principalmente grazie ad una emissione di quest’anno che ha fruttato $13.8M ed ha qualche evento binario potenzialmente interessante in dirittura d’arrivo. Ciliegina sulla torta: capitalizza $70M circa mentre vi scrivo.
Long story short: Curis sta sviluppando emavusertib (CA 4948) , IRAK/FLT3 inibitore che sembra avere un futuro nel trattamento di linfomi e leucemia e che attualmente è dosato in 4 trials, come da tabella che vi allego qui sotto:
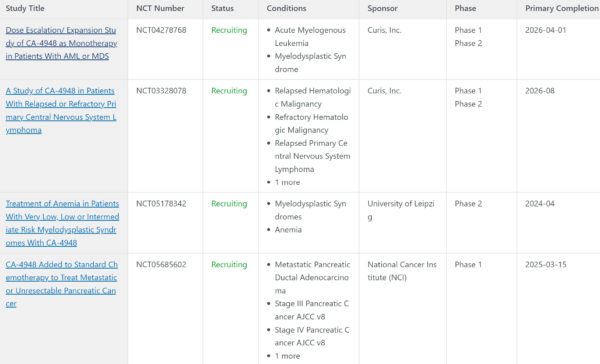
I primi due studi della lista sono quelli che interessano a noi e da qui in avanti saranno chiamati rispettivamente TakeAim Leukemia e TakeAim Lymphoma. Tutti e due gli studi sono stati oggetto di presentazioni lo scorso ASH e, se corredati da esiti positivi, concorreranno a tracciare il futuro verso l’approvazione per emavusertib; adesso vediamo come, in che indicazioni e con che tempistiche.
Leucemia
TakeAim Leukemia è uno studio multicentrico, in aperto, di fase 1/2a, a dosaggio scalare e con fase di espansione che vede emavusertib (CA-4948) somministrato per via orale come monoterapia in pazienti adulti con leucemia mieloide acuta (AML) o sindrome mielodisplastica (hrMDS) ad alto rischio.
I pazienti che nella fase 1 dello studio devono soddisfare uno dei seguenti criteri prima di acconsentire alla partecipazione allo studio:
- AML recidiva/refrattaria con mutazioni FLT3 precedentemente trattati con un inibitore di FLT3
- AML recidiva/refrattaria con mutazioni dello spliceosoma di SF3B1 o U2AF1
- hrMDS recidiva/refrattaria con mutazioni dello spliceosoma di SF3B1 o U2AF1
- 1 o 2 trattamenti precedenti
L’espansione della dose della fase 2a avverrà in 3 coorti di pazienti:
- AML recidiva/refrattaria con mutazioni FLT3 precedentemente trattati con un inibitore di FLT3;
- AML recidiva/refrattaria con mutazioni dello spliceosoma di SF3B1 o U2AF1
- hrMDS (punteggio IPSS-R > 3.5) recidiva/refrattaria con mutazioni dello spliceosoma di SF3B1 o U2AF1.
Senza stare a diventare matti i punti salienti della vicenda sono che Curis può cercare un’approvazione in pazienti rrAML se riuscirà a dimostrare di poter produrre risposte complete in pazienti con mutazione FLT3 e nel complesso dello spliceosoma.
Le mutazioni nel gene FLT3 e nel complesso dello spliceosoma sono entrambe associate a condizioni mediche specifiche, ma agiscono in modi differenti nelle cellule.
Le mutazioni in FLT3 sono associate a diverse forme di AML e le più comuni sono FLT3-ITD (duplicazione interna in tandem) e FLT3-TKD (mutazione nel dominio chinasico). Queste mutazioni possono portare a un’eccessiva proliferazione delle cellule del sangue e ad una prognosi meno favorevole per i pazienti affetti da AML.
Curis, in questo segmento, può fare riferimento agli inibitori di FLT3 già approvati per avere una misura di quanto sia alta la barra da saltare, lo stesso purtroppo non si può dire per quanto riguarda la mutazione dello spliceosoma, perché qui di strada ce ne’è parecchia da fare. Stando alla compagnia ogni risposta che inducono è un ottimo segnale e certamente hanno ben donde di affermarlo, ma capire oltre quale soglia si possa parlare di un successo è tutt’altra cosa.
In linea di massima, con i dati attesi nella prima metà del 2024 (io direi 2q24), avere un tasso di CR superiore al 20% in pazienti FLT3+ sarebbe di ottimo auspicio, mentre per i pazienti con mutazione dello spliceosoma sarà opportuno guardare ai dati sulla sopravvivenza per far felice il mercato.
Quello che ci è dato di sapere al momento, in base a quanto presentato lo scorso ASH è che, al dosaggio stabilito per la fase 2, i pazienti FLT3+ valutabili hanno ottenuto questo tipo di risposta:
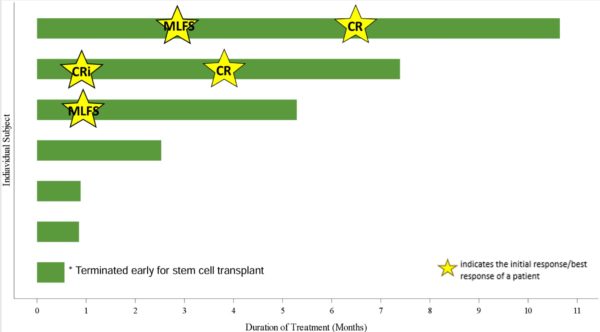
Due CR su 7 pazienti fanno si che il tasso di risposta sia del 28%, dato che (in considerazione del fatto che il cut off risale a giugno 2023) sarà sicuramente diverso oggi giorno. Ci saranno più pazienti valutabili ed il tasso di risposta sarà cambiato ma, da quanto emerge nella presentazione, i numeri sono molto confortanti, pur se esigui.
Se invece rivolgiamo lo sguardo ai pazienti AML e MDS disponibili per la valutazione possiamo intuire che ci siano state delle risposte, il che è incoraggiante, ma è difficile trarre conclusioni visto che non ci è dato sapere i dosaggi impiegati e quali siano le mutazioni associate ai pazienti nel grafico dato che il poster era incentrato sui pazienti con mutazione FLT3.
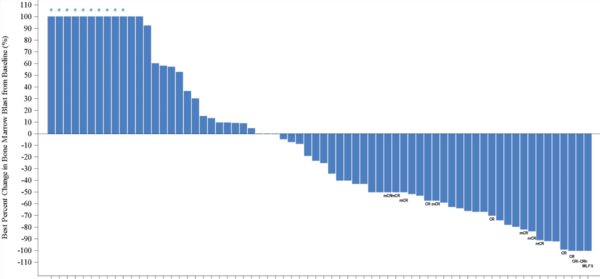
Come detto in precedenza, per fare il punto della situazione occorre attendere il prossimo anno con un aggiornamento corposo riguardo la fase attuale, ossia l’espansione con il dosaggio fissato (300mg BID) in soggetti con ≤ 2 terapie precedenti. Al momento mi sento di dire che emavusertib sembra avere una certa attività antitumorale nei pazienti con FLT3 mutato, inclusi soggetti che hanno avuto una progressione dopo aver ricevuto un inibitore precedente di FLT3 ed in particolar modo in coloro i quali hanno avuto 1 o 2 linee terapeutiche precedenti. Per il resto il giudizio è sospeso, ma intanto una possibile strada verso l’approvazione ci sarebbe.
hrMDS
Discorso più complicato per questa indicazione, rispetto alla quale Curis è in fase di vigile attesa. La situazione verrà sbloccata quando saranno disponibili i dati dello studio VERONA condotto da Abbvie e sarà quindi chiaro se emavusertib dovrà essere dosato in combo con la sola azacitidina o aggiungendo anche venetoclax. Il tutto si traduce nel fatto che altre considerazioni circa il dosaggio saranno presumibilmente da portare avanti per evitare che la safety del trattamento sia un problema, tempi più lunghi insomma. Va da se che i dati che comunque presenteranno saranno da osservare con attenzione, ma anche nella migliore delle ipotesi, ossia che emavusertib si dimostri efficace, tradurre l’entusiasmo iniziale in un serio discorso sul futuro in questa indicazione sarà più laborioso.
Linfoma
Qui Curis ha già identificato una strada promettente ed ha presentato ad ASH dati che, sebbene siamo sempre nel regno dei piccoli numeri, possono essere considerati incoraggianti.
TakeAim Lymphoma (NCT03328078) è uno studio in aperto che vede dosato emavusertib sia in monoterapia che in combinazione con ibrutinib. La Parte A1 (già completata) ha coinvolto il dosaggio scalare di emavusertib come monoterapia e si è conclusa determinando la dose raccomandata per la fase 2 (RP2D) di 300mg due volte al giorno (BID). La Parte A2 (dosaggio scalare in combinazione con ibrutinib). La Parte B ha visto i pazienti suddivisi in 4 coorti di espansione di emavusertib e ibrutinib:
- linfoma della zona marginale (Marginal Zone Lymphoma o MZL) naive a BTK inibitori
- linfoma diffuso a grandi cellule B (DLBCL)
- linfoma primario del sistema nervoso centrale (PCNSL)
- linfoma non-Hodgkin (NHL) con resistenza adattiva a ibrutinib
Il trattamento del PCNSL rappresenta la via più promettente verso l’approvazione per via del fatto che l’indicazione è orfana e le opzioni terapeutiche scarseggiano, un classico “bisogno medico insoddisfatto” (Unmet Medical Need, per dirlo nella lingua d’Albione).
Affinchè la combo abbia senso occorre che il profilo di tollerabilità della terapia sia accettabile e che il tasso di CR si attesti oltre il 20%, possibilmente oltre il 25%.
I dati presentati al meeting si riferiscono a 5 pazienti affetti da PCNSL con precedente trattametno con BTK inibitore e sono riassunti nella tabella seguente:
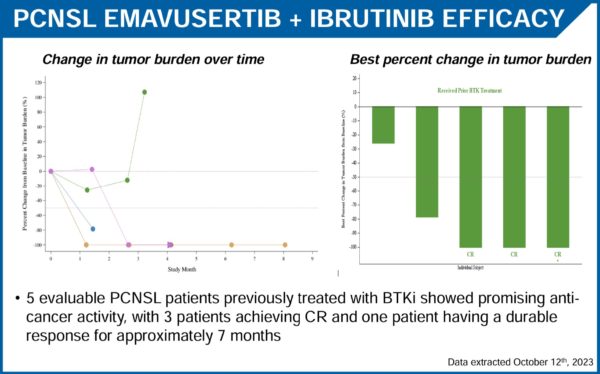
Come si può leggere il tasso di CR è, per quel che può valere visto il ridotto numero di pazienti, del 60% e la durata delle risposte sembra incoraggiante.
Per quel che riguarda il totale dei pazienti valutabili possiamo osservare l’immagine seguente:
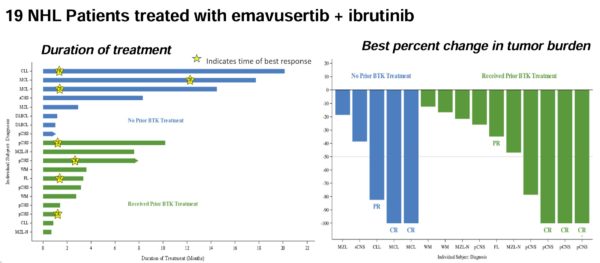
Nel grafico di sinistra abbiamo la durata del trattamentocon l’indicazione delle risposte ottenute al cut off dei dati, in quello di destra le migliori risposte ottenute. Le barre blu si riferiscono a pazienti BTKi naive e quelle verdi a soggetti con precedenti trattamenti con BTKi. La media dei trattamenti precedentemente subiti dai pazienti è di 3, quindi ci si rivolge a soggetti pesantemente pretrattati (range 1-10).
Il tasso di CR in tutti i pazienti valutabili è del 31% (5/16, 2 MCL e 3 PCNSL come detto prima). Se escludiamo dall’equazione il PCNSL il tasso di CR è del 18% (2MCL) circa mentre il tasso di risposta globale è del 36% grazie alle due PR (1FL ed 1CLL). Ad aggiungere confusione al tutto c’è un’altra questione, ossia quella del dosaggio. Dei 19 pazienti ai quali è stata somministrata la terapia solo 10 hanno ricevuto il dosaggio 200mg, quello che verrà impiegato nella fase espansione per il trattamento del PCNSL, mentre 7 hanno ricevuto 300mg e 2 il dosaggio a 100mg.

Ma non è finita, perché in un terzo abstract presentato dalla compagnia il disegno dello studio indica anche un dosaggio 100mg:
Do per scontato che utilizzino il dosaggio 200mg BID, ma un po’ più di chiarezza sarebbe gradita.
Conclusione 1
La cassa dura fino al 2025 e grazie al recente reverse split non sono a rischio delisting. Hanno in mano un solo assetto ma con almeno una indicazione chiaramente perseguibile e gli studi sono in fase abbastanza avanzata, infatti, nonostante il clinical hold subito credo che abbiano recuperato parte del terreno e mi pare che il management, seppur fastidioso in certi atteggiamenti, abbia le idee chiare.
Vanno evidenziate anche le note meno positive: ancora non c’è un disegno ben chiaro di come sarà possibile arrivare all’approvazone di emavusertib, ne per quanto riguarda PCNSL ne per AML FLT3 e, ribadisco, i dati finora presentati sono riferiti ad un numero di pazienti limitato.
Curis è un titolo che avrà una svolta nel 2014, in un senso o nell’altro e, tenendo conto che capitalizza poco più di $70M, tende a risultare attraente, ma vi invito a ricordare che fino a non molto tempo fa quotava meno di $4, prima di iniziare a salire fino ai livelli attuali.
Conclusione 3
Terzultima cosa, lascia che ti faccia i miei migliori auguri per le prossime festività. Ti consiglierei di passare i giorni a cavallo fra il 2023 ed il 2024 senza pensare a Curis, ma temo che il tarlo si sia già insinuato nella tua testa. In questo caso tieni bene a mente cosa ho detto nella conclusione 2. Mi raccomando.
Penultima cosa, comunicazione di servizio, visto che ormai siamo allo sbando, direi che è il caso di iniziare con i messaggi criptici sullo stile Radio Londra: vignetta in scadenza, tartare in circolazione, vediamo di darci una mossa.
Ultima cosa: stai cercando il link in descrizione per sapere qual è il miglior modo per sbattere la testa quando si è piccoli? Ok, io avrò un sacco di problemi, ma anche tu non sei messo bene…
Oh, sei ancora qui? Cerchi la conclusione 2? Bazinga!

Ciao Andrea un tuo commento su Afmd che dai massimi di 8,95$ è tornato sui 5$?
Ciao Andrea.
Ho inviato una lettera per te.
Email
Per quando in un prossimo futuro ci sara’ un nuovo post.
Mi sono perso qualcosa?.
Ciao.
Con amicizia….
Una buona gionata.
Ciao Andrea, è possibile un commento/aggiornamento su Affimed e Oncternal che dovrebbero avere dati entro breve? Colgo l’occasione per augurare Buona Pasqua a tutti!
Buongiorno Andrea, un commento sulla capitalizzazione sempre più “small” di Agenus? grazie mille e Buona Pasqua.
Buon finale d anno e un felice e prospero 2024
Bentornato Capitano!
Auguri di Buon Natale e Buon Anno.
Grazie.
Buon Natale e Felice Anno Nuovo.
Con in portafoglio, da anni sempre e comunque: Curis.
È sempre un piacere leggere un tuo “pezzo’ anche se non trattasse di preziose informazioni sulle azioni bio!!!
Il più bel regalo di Natale
Primo! ?
Bentornato dalle steppe Capitano! Come sempre lucido 🙂
Già carico a bumbazza di CRIS da tempo , seduti in riva al fiume ed aspettiamo .. Buon Natale a tutti!