Mentre vi scrivo Ablynx rende noti i dati di vobarilizumab (meglio conosciuto come ALX 0061) ed il mercato reagisce bene, molto bene. Io sono più tiepido. Ad un primo sguardo i numeri non mi sono sembrati così confortanti e sto attendendo la conference call per chiarirmi alcuni aspetti. Se dovessi ricredermi cestinerò l’articolo e manterrò inalterata la posizione, se però state leggendo queste mie elucubrazioni… beh, avete già capito.
Iniziamo dai dati presentati dalla compagnia:
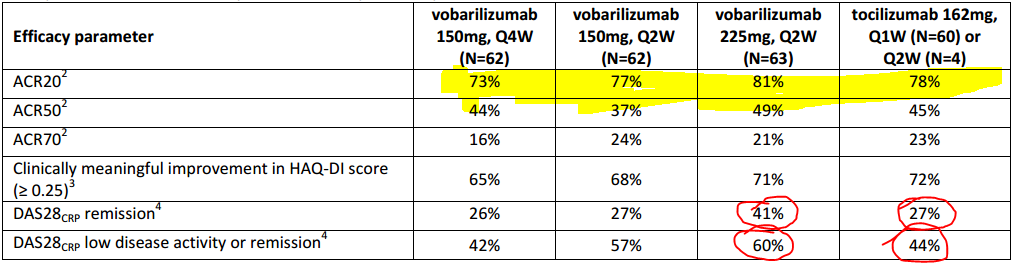
I pazienti arruolati in questa fase 2 sono stati randomizzati a ricevere vobarilizumab in 3 modalità di somministrazione e dosaggio, così come riportato dall’immagine qui sopra, mentre 64 soggetti sono stati assegnati ad un braccio in modo che potessero ricevere Actemra (tocilizumab) ogni settimana, fatto salvo 4 pazienti che lo hanno ricevuto ogni due settimane. L’endpoint primario dello studio era l’ACR20 e come si può notare nella zona evidenziata, due bracci su tre risultano inferiori ad Actemra. Stessa sorte vale per ACR50 ed ACR70. Non mi pare si possa dire che ci sia un chiaro effetto legato al dosaggio, ne necessariamente che la somministrazione ogni due settimane sia preferibile sempre a quella ogni quattro settimane. Laddove i numeri fanno propendere per i 225 mg Q2W è quando si prende in considerazione il punteggio DAS28-CRP, ma anche in questo caso due coorti su tre fanno peggio di Actemra.
Ora, se ACR20, ACR50 ed ACR70 sono abbastanza simili rispetto al controllo, è normale che il DAS28-CRP sia così smaccatamente a favore di vobarilizumab e cosa comporta ciò? Che peso può avere per il successo della terapia?
ACR20, per farla breve, è la percentuale di pazienti che ha ottenuto un miglioramento documentato dalla riduzione di almeno il 20% del numero di articolazioni dolenti e tumefatte, e del 20% di almeno 3 di ulteriori 5 parametri (livello di PCR, punteggio HAQ, 6-8, e punteggio scala VAS dolore, VAS medico e VAS paziente). Stessa cosa per ACR50 e 70, dove chiaramente il livello di miglioramento deve aver ecceduto il 50 ed il 70%. Il livello di PCR (proteina C reattiva) quindi, gioca un ruolo minore, nel calcolo di questi parametri. Stessa cosa non si può dire per quanto riguarda il DAS28-CRP.
Dal punto di vista della distribuzione dei pazienti va detto che alla baseline il DAS28-CRP nel braccio 225mg (prendo in considerazione solo questo per comodità e perché è l’unico che supera il controllo con questo tipo di misurazione) è in linea con quello di tocilizumab (6.1 vs 6.2). La PCR invece è di 17,7 per il braccio Q4W; 23,6 per il 150 mg Q2W; 33,5 per il 225 mg e 22,0 per il controllo. Qui un certo sbilanciamento c’è il livello di PCR entra in maniera sensibile nel computo del DAS28-CRP, che però risulta simile alla baseline, fra i bracci attivi ed il controllo, il che significa che sono gli altri valori ad essere diversi. Il numero di articolazioni dolenti o tumefatte però è molto simile a quello del controllo (TJC68 e SJC66 sono rispettivamente 25.8 e 17.3 per il braccio da 225 mg vs 27.3 e 17.3 per il controllo) quindi l’unica variabile rimanente è lo stato di salute complessivo.
Da cosa deriva quindi questo DAS28-CRP così migliore rispetto al controllo? Abbiamo detto che è lecito supporre che il numero di giunture doloranti o tumefatte sia del tutto simile a 12 settimane fra i pazienti che hanno ricevuto vobarilizumab e tocilizumab, il che si desume dal fatto che ACR20, ACR50 ed ACR70 sono sostanzialmente simili fra loro. Sappiamo dalla conference call che anche per quanto riguarda il miglioramento del punteggio HAQ-DI è simile se confrontiamo il braccio a 225 mg con il controllo (71% vs 72%), quindi a cosa dobbiamo questo vantaggio in termini di remissione o comunque di bassa attività della malattia? A mio avviso non è per nulla chiaro questo aspetto e non aiuta di certo il fatto che lo studio non abbia sufficiente potenza per mostrare un vantaggio statistico, a differenza di quanto accaduto tempo fa con filgotinib di Galapagos NV. Perché cito filgotinib? Perché, ovviamente, il rischio è che AbbVie non ritenga necessario approfittare dell’opzione per accaparrarsi definitivamente dei diritti di vobarilizumab.
Vobarilizumab e filgotinib, due storie diverse, due finali diversi?
Vobarilizumab e filgotinib hanno molti punti in comune, a cominciare dal fatto che tutti e due sono stati oggetto delle attenzioni di AbbVie, che ha pagato fior di milioni di euro per potersi assicurare il diritto ad esercitare una opzione sui composti, previa verifica dell’attività in fase 2 dei suddetti. Filgotinib è andato alla grande, nonostante ciò AbbVie l’ha scaricato. Qui siamo in una posizione diversa, visto che il motivo principale della scelta di AbbVie con Galapagos era il fatto di avere già un JAK1 inibitore in pipeline, mentre al momento non c’è nemmeno un candidato con target IL-6R nella pipeline di AbbVie. Resta il fatto che in mono-terapia non si è ancora dimostrato un beneficio così netto rispetto a tocilizumab, se non nel tasso di remissione, nel profilo di tollerabilità e nella comodità di somministrazione. Tutto questo vale la montagna di danaro che AbbVie dovrebbe sborsare? Il rischio che la risposta sia no è alto, al momento, tuttavia credo che la decisione sia da rimandare a quando si avranno i dati della fase 2 di combinazione, presumibilmente durante la prima metà di agosto.
Conclusione.
Non credo che il DAS28 sia un metro affidabile per stabilire quanto vobarilizumab sia superiore a tocilizumab a causa del fatto che la misura è troppo dipendente dai livelli di proteina C reattiva, livello che viene chiaramente influenzato nel momento in cui si somministra una agente diretto ai recettori dell’IL-6, il che però non si riflette automaticamente in un vantaggio dal punto di vista dell’efficacia del trattamento. Dai valori di ACR20, 50 e 70 non sembra emergere un vantaggio in favore del nano-corpo di Ablynx, anche se la tollerabilità e la minor frequenza di somministrazione, a parità di efficacia, farebbe propendere l’ago della bilancia in favore di Ablynx. Questo però potrebbe non bastare ad AbbVie, motivo per il quale vendo ora e mi porto a casa il lauto guadagno che finora la compagnia mi ha gentilmente concesso.
Durante la prima metà di agosto arriveranno i dati della fase 2 in combo e probabilmente faremo più chiarezza circa la reale efficacia di vobarilizumab. E bene precisare che finora i dati elargiti da Ablynx hanno confermato una efficacia notevole, se presi singolarmente, quindi ci sono buone possibilità che anche i prossimi saranno positivi. In base a questo ragionamento i più arditi investitori potranno attendere il verdetto della combinazione prima di decidere se rischiare con AbbVie o meno. Io mi sento poco coraggioso e ad agosto preferisco non essere particolarmente esposto.
Ultime considerazioni, prendetele per quel che possono valere.
All’ultimo controllo (Q1) Ablynx aveva 233 milioni di euro in cassa, cifra piuttosto cospicua che chiaramente si assottiglia giorno dopo giorno ma alla quale, se AbbVie eserciterà la sua opzione, si andranno ad aggiungere ulteriori 75 milioni di dollari. La compagnia belga ha una pipeline il cui sviluppo è piuttosto oneroso, cionondimeno il danaro non le manca al momento e, con la previsione di incassare milestones da AbbVie, stona un po’ l’emissione di nuove azioni fatta a giugno, un mese prima di avere in mano i dati di vobarilizumab. Non c’è bisogno di dire che Ablynx ha fatto bene, visto che una delle regole d’oro del biotech e quella di battere cassa quando si può e non quando se ne ha bisogno, però il tempismo mi lascia un po’ perplesso. Nella PR comunicano che il danaro raccolto servirà per i seguenti scopi:
Ablynx will use the net proceeds of the Transaction to:
Fund optimal clinical development and commercialisation of the Company’s most advanced assets:
– potentially expand indications for caplacizumab and ALX-0171
– allow increased strategic and financial flexibility in the further development of ALX- 0061;
Initiate, continue to advance, and/or accelerate the pre-clinical and clinical development of the other wholly- and co-owned programmes to further expand the Company’s diverse portfolio;
Explore the acquisition of complementary assets;
Continue to build momentum for the Nanobody® platform in therapeutic areas which involve novel delivery routes and multi-functional approaches such as T-cell engagers;
Further develop the Company’s manufacturing capabilities, and;
Fund general corporate purposes
Il grassetto laddove si parla di ALX 0061 è opera mia.
Ultima questione, la storia delle siringhe già pronte da utilizzare. Devo ringraziare Massimo per avermi fatto tornare alla memoria la vicenda poiché l’avevo completamente rimossa, il che è un peccato dato che potrebbe indicare che AbbVie sia già legata con Ablynx per lo sviluppo del nano-corpo. In sintesi i fatti sono i seguenti: AbbVie tempo fa ha stretto un accordo con Unilife e, stando ad alcuni report di Bryan,Garnier & Co quest’ultima starebbe già lavorando ad un autoinjector dedicato a vobarilizumab. Chiaramente non metto in dubbio questo fatto, ma andando a ritroso nel tempo ho trovato altri report del 2015 nei quali la notizia era già apparsa, il che la depotenzia, a mio modo di vedere o, per meglio dire, sta a significare solo che AbbVie probabilmente si era portata avanti con il lavoro, ma che non abbia ancora deciso. Piccola nota di colore, Bryan Garnier & Co coprono anche Galapagos NV, ma non mi risulta avessero capito che AbbVie li avrebbe mollati all’altare, nonostante qualche indizio già fosse stato fornito dalla stessa AbbVie in una conference call. Oh, sia chiaro, anche io mi ero perso l’affermazione riguardo l’inizio della fase 3 per ABT-494, non sto certo dicendo che sono più scaltro di loro…
Fatte tutte queste considerazioni ci sono sostanzialmente due opzioni:
- uscire subito.
- rischiare i dati ad agosto.
Sapete per cosa opto io, ma rischiare i dati sarebbe così assurdo? Il rischio c’è sempre, ma è lecito attendersi che i numeri saranno buoni, per quello che si è visto finora. Ripeto il concetto, non sono deluso dai dati di Ablynx, sono deluso dalla mancanza di differenza rispetto al controllo, che nello studio del quale vi ho parlato finora ha fatto anch’esso molto bene. Diffido del valore dei dati sulla remissione perché ritengo che sopravvalutino l’efficacia di vobarilizumab, per i motivi sopra esposti, questo è vero, ma non posso certo dire che i dati siano meno che positivi. Chi decidesse di attendere agosto potrebbe essere premiato ulteriormente ed a quel punto potrebbe trovarsi a dover fare la scelta fatidica: fidarsi o meno di AbbVie?

@Katafaskio, sto lavorando al PDF in questi giorni. parto sabato, ma prima di allora ci sarà il documento pronto con la situazione dei portafogli, con particolare riferimento agli eventi in attesa, ad un aggiornamento su Molmed dopo l’incontro con il management e (ma questo tempo permettendo) con uno spazio su un paio di compagnie molto interessanti…
CK prima delle vacanze ,tempo permettendo, farai il punto della situazione del ptf e piano d azione Settembre Dicembre ?
@Frimba, non la conosco bene…
ciao ck ennesima domanda 🙂 GWPH la conosci?a me intriga moltissimo e il titolo rimane solido,opinioni sull azienda??l altro ieri ha pure emesso,90 potrebbe essere un buon pavimento.
@Lucaluca, visto, grazie… io non aderirò, attendo di capire dove vogliono andare a parare, ma mi pare chiaro che non cia sia un partner al momento disponibile…
@Frimba, non ho notizie su $CALA, mi spiace…
@LsW, direi che come in tutte le fase di stanca, a farne le spese sono le compagnie che con l’indice maggiore non hanno a che fare, le smid cap… senza un particolare criterio sembra!
nonostante l indice biotech siano 7 mesi in movimento laterale venendo da un calo di altri 5 mesi , non riesco a farmi una ragione che molti titoli siano continuamente massacrati… anche oggi che l’ indice fa un meno 1 e rotti ci sono titoli in balia dei soliti noti e perdono l’8% …. bhà veramente una m…
CK non so se hai visto i volumi di ieri su CALA oltre 2ml di pezzi scambiati e prezzo praticamente fermo?per me stanno accumulando e sta per uscire qualcosa,oggi penso di prenderne un cippino,tanto ora CALA vale praticmanete la cassa..credo possa esser un buon minimo.
A me hanno comunicato questo 2 giorni fa, termine per decidere il 22 luglio entro le 15
ex date 5 luglio 2016, le è stata riconosciuta
un’assegnazione gratuita di diritti non trasferibili
Onconova Ther. Rts 16 (US6829965093), nella misura di n. 1,5
diritti per ogni n. 1 azione ordinaria posseduta. I diritti,
caricati in data odierna, saranno visibili da domani nel
Portafoglio offline.
Lei ha la possibilità di scegliere tra 2 opzioni:
1) Optando per l’esercizio riceverà n. 1 nuova UNIT per ogni
n. 1 diritto esercitato ad un prezzo di sottoscrizione di
USD 4,9 per UNIT.
Ogni Unit riveniente sarà composta da un’azione (ISIN
US68232V3069) e nr. 0,75 Warrant (ISIN NON COMUNICATO)
che verranno emessi separatamente al termine di esercizio
dei diritti.
I Warrant (ISIN NON COMUNICATO) sono esercitabili per un
periodo di 5 anni dall’emissione e ogni warrant da diritto a
sottoscrivere n. 1 azione ordinaria Onconova Therapeutics
Inc al prezzo unitario di USD 5,88.
2) Astenersi da qualsiasi iniziativa.
In mancanza di disposizioni per l’esercizio, i diritti
rimasti verranno scaricati come privi di valore
Ora però non saprei che fare, qualche consiglio?
Grazie mille
@Stefano, ma ti pare che se avevo titoli super li davo via? 😉
@Luca, ma solo a me non li hanno caricati questi dannati diritti?
Salve a tutti per i possessori di ontx ci chiedevo cosa pensate di fare con i diritti di opzione? Cereal qualche consiglio? Come al solito grazie mille
Cerialkiller da quanto tempo,ora mi riprendo tutta la mia fortuna.dammi titoli super ok