Exelixis ha recentemente preso parte alla Morgan Stanley Global Healthcare Conference e per quel che mi è dato sapere il CEO, Michael Morrissey, non ha praticamente parlato di due aspetti di notevole interesse per la compagnia: le vendite off-label di Cometriq (Cabozantinib) e lo stato di sviluppo di Cobimetinib (XL 518/GDC 0973).
Se non me lo dicono loro, provo ad avanzare qualche ipotesi io… prima però un breve riassunto delle puntate precedenti.
William Blair stima un mercato del carcinoma prostatico triplicato dai valori attuali per raggiungere la ragguardevole cifra di 12 miliardi di dollari nei prossimi 10 anni e di certo Exelixis (EXEL) vuole far parte di questo panorama grazie al già approvato, per differente indicazione (MTC, cancro midollare della tiroide), Cabozantinib/Cometriq. Exelixis dovrà fare i conti (ammesso che le 2 fasi 3 , COMET-1 e COMET-2, arrivino a buon fine) con farmaci che stanno già riscrivendo la pratica del trattamento di questi tumori e con farmaci che potrebbero farlo in futuro. Recentemente Yervoy ha fornito dati piuttosto contraddittori, anche se non fallimentari come qualcuno li ha dipinti. Mancano all’appello ancora Ipsen con tasquinimod, Bavarian Nordic con il vaccino Prostvac ed OncoGenex con custirsen, giusto per fare qualche nome.
Exelixis punta forte sull’efficacia di Cabozantinib e sul meccanismo peculiare del farmaco, che ha mostrato una straordinaria efficacia rispetto alle metastasi ossee, con la conseguenza di diminuire il dolore nei pazienti, migliorandone la qualità della vita e (potenzialmente) estendendone la sopravvivenza. Nel segmento del cancro alla prostata Exelixis conta anche a catturare i pazienti che si dimostrassero resistenti a Xtandi e Zytiga e ad affiancare Cabo a Xofigo, considerando i due farmaci complementari. Sempre in termini di impiego congiunto, a breve inizierà una fase 2 nel quale il TKi di Exelixis verrà somministrato assieme a Zytiga.
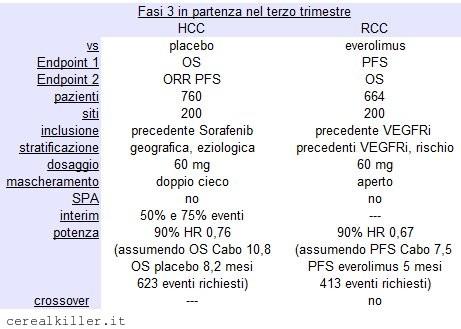
Oltre a questa indicazione, Exelixis ha iniziato da pochissimo la fase 3 CELESTIAL, nella quale Cometriq verrà valutato Vs placebo in pazienti con carcinoma epatocellulare (HCC) con precedente esposizione a sorafenib. Tre anni di arruolamento per i 760 pazienti previsti, dati disponibili per fine 2016 o inizio 2017. In questo caso sarà interessante valutare come la capacità di inibire MET di Exelixis possa influire sullo studio, anche in considerazione di quanto visto per Tivantinib di ArQule, MET inibitore attualmente in fase 3 per il trattamento di pazienti con HCC nello studio METIV-HCC. Le differenze principali in queste due fasi 3 molto simili (HCC in seconda linea, studio randomizzato vs placebo) stanno nel fatto che METIV seleziona pazienti con un biomarker (alta espressione MET) ed ha recentemente subito una modifica inerente il dosaggio (ne ho scritto pochi giorni fa). Cabozantinib in CELESTIAL è somministrato a 60 mg, contro i 100 mg dello studio EXAM, quello che ha portato all’approvazione in USA del farmaco per MTC, quindi a dosaggio già ridotto.
Stesso dosaggio anche per METEOR, altra fase 3 ma in pazienti con carcinoma renale (RCC) e vs Afinitor, farmaco che occupa circa il 40% del mercato. In questo caso i dati sono attesi per il 2015.
Vi ho parlato, in un articolo scritto qualche settimana fa, della possibilità di inserirsi anche nella nicchia del trattamento del tumore al polmone con fusione RET, bene, entro fine anno potrebbe già partire la fase 2. Se ricordate l’articolo, vi parlavo di come sia AstraZeneca che Exelixis avessero sfruttato le capacità di inibire RET dei farmaci per trattare il carcinoma midollare della tiroide. Vi ho detto ai tempi che secondo me Cometriq è superiore in termini di efficacia rispetto a Vandetanib, il concorrente di AstraZeneca e le prime cifre relative alle vendite sembrano testimoniare questo. Exelixis ha riportato vendite di Cometriq per un ammontare di circa 4 milioni di dollari, dato che mi sembra estremamente positivo, se riferito unicamente alle vendite legate al carcinoma midollare della tiroide. Si tratta di un mercato lento nel quale Vandetanib ha fatto fatica ad imporsi nonostante l’impiego off label e la mancanza di concorrenti di peso, un mercato che può contare su soltanto 500-750 pazienti anno in USA (con stime simili per l’Europa). A questo dovete aggiungere il fatto che Cabo costa meno di 10 mila dollari a ciclo.
Cabo è stato approvato lo scorso novembre ed i 4 milioni sono riferiti al 2Q13, cioè dopo pochissimo tempo dal lancio. Goldman Sachs stimava i possibili introiti in circa 2 milioni di dollari ed era fra i più ottimisti (penso che il picco di positività si sia assestato sui 2,5 M$), quindi la metà di quanto effettivamente raccolto, possibile sia tutto frutto del piccolo mercato della tiroide? Dovendo scommettere un euro, sarei disposto a puntare sul fatto che in alcune indicazioni come fegato e reni il farmaco sia (almeno in parte) rimborsato dalle compagnie assicuratrici, per la prostata non saprei. Fegato e reni sono indicazioni con scarse opportunità, trials esclusi, nella prostata il campo si fa affollato e la stessa Exelixis offre non uno ma due studi registrativi di notevoli dimensioni e con criteri di inclusione piuttosto ampi. I due studi COMET sul tumore alla prostata termineranno nel 2014, ma continuano ad arruolare; la presenza sul mercato di Xofigo, Jevtana, Zytiga e Xtandi rende di certo meno impellenti il bisogno off label di un farmaco come cabozantinib. Il CEO non ne parla praticamente mai, così come nulla dice sul secondo farmaco in fase 3: Cobimetinib.
 Per chi si fosse perso le puntate precedenti Cobimetinib altri non è che XL 518/GDC 0973, MEK inibitore di casa Exelixis concesso in licenza a Roche/Genentech che dopo averlo testato in fase 1 in pazienti affetti da melanoma lo ha spedito direttamente in fase 3. Entro novembre Exelixis dovrà decidere se esercitare l’opzione per commercializzare il farmaco assieme a Roche, qualora arrivi il via libera di FDA, nel frattempo ad ESMO il colosso presenterà l’aggiornameto dei dati della prima fase di sperimentazione. I dati finali della fase 3 arriveranno nel 2014 e, data la natura dello studio, non sarà difficile che consentano a Roche di centrare l’endpoint primario, visto che l’obiettivo è dimostrare che Cobimetinib e zelboraf sono più efficaci del solo zelboraf. Il problema sarà confrontare quei dati con le altre coppie di MEK/BRAF inibitori che si stanno affacciando al mercato. In fase 1 MEK162 e LGX818 di Array (ARRY)/Novartis hanno ottenuto un tasso di risposta dell’88% e del 18% rispettivamente in 7 pazienti BRAFi naïve e in 9 pazienti precedentemente sottoposti a regime con BRAFi. GSK con dabrafenib/trametinib ha ottenuto risposte nell’ordine del 63/76% su pazienti mai trattati con BRAFi, per Exelixis e Cobimetinib/Zelboraf si tratterà di stabilire come classificare con precisione il 92% di tasso di risposta mostrato lo scorso ESMO.
Per chi si fosse perso le puntate precedenti Cobimetinib altri non è che XL 518/GDC 0973, MEK inibitore di casa Exelixis concesso in licenza a Roche/Genentech che dopo averlo testato in fase 1 in pazienti affetti da melanoma lo ha spedito direttamente in fase 3. Entro novembre Exelixis dovrà decidere se esercitare l’opzione per commercializzare il farmaco assieme a Roche, qualora arrivi il via libera di FDA, nel frattempo ad ESMO il colosso presenterà l’aggiornameto dei dati della prima fase di sperimentazione. I dati finali della fase 3 arriveranno nel 2014 e, data la natura dello studio, non sarà difficile che consentano a Roche di centrare l’endpoint primario, visto che l’obiettivo è dimostrare che Cobimetinib e zelboraf sono più efficaci del solo zelboraf. Il problema sarà confrontare quei dati con le altre coppie di MEK/BRAF inibitori che si stanno affacciando al mercato. In fase 1 MEK162 e LGX818 di Array (ARRY)/Novartis hanno ottenuto un tasso di risposta dell’88% e del 18% rispettivamente in 7 pazienti BRAFi naïve e in 9 pazienti precedentemente sottoposti a regime con BRAFi. GSK con dabrafenib/trametinib ha ottenuto risposte nell’ordine del 63/76% su pazienti mai trattati con BRAFi, per Exelixis e Cobimetinib/Zelboraf si tratterà di stabilire come classificare con precisione il 92% di tasso di risposta mostrato lo scorso ESMO.
Nel frattempo, lasciamo pure che non ne parlino.
Altra giornatina da archiviare…..’mazza ‘e schifezza!
Intanto loro almeno qualche accenno a Cobimetinib cominciano a farlo…
dentro su EXEL. stop appena sotto 4,71.
per domani metto in watch EXEL. siamo a livello di ipervenduto , se tocca la media a 200 periodi in area 4,95 entro con un missile….
prezzo obiettivo la resistenza a 5,50-5,55.
Perché adesso ogni volta che si vuole postare un messaggio bisogna scrivere nome e indirizzo? Perché? Voglio sapere perché. Perchééééééééééééé????????
Da un’indagine accurata risulta che sono l’unico a confondere le aziende con nome simile… però anche tu, nel 21° secolo, ancora viaggi con i post-it attaccati al monitor?
CYTR(CytRx Corporation per chi si confonde!!!) se ne sta andando verso 3$
e che me la ero segnata sul postit che ho davanti al naso “2.35 vedere dopo ASCO”…..
Grazie Paolo, articolo estremamente interessante… la struttura di diversi MEKi fa si che alcuni abbiano maggiore affinità verso alcuni tumori rispetto ad altri. Il che, per noi investitori, è importante perché significa che determinati farmaci possono trovare spazio in un settore che si sta facendo molto affollato… interessante anche il fatto che si parli specificatamente di Cobi…
http://www.nature.com/nature/journal/v501/n7466/fig_tab/nature12441_ft.html
scusate mancava la L in fondo
grunf….grunf…..
Io invece sono un impreparato totale, mi fido pochissimo e faccio rumori molesti mentre mangio. E comunque non mi si apre il link di Paolo V.
Io invece sono un’impreparata totale che si fida poco. 😀
http://www.nature.com/nature/journal/v501/n7466/fig_tab/nature12441_ft.htm
Un esempio di dove non capisco una mazza, nulla, buio totale! Ve lo dico cosi sapete con chi avete a che fare: con un impreparato totale che si fida dei pareri degli altri. Grazie di cuore CK
Research identifies a mutation that predisposes individuals to most common form of childhood leukemia.
Prego, cicciolone! 😀
Grazie Elisa!
DENDREON CORPORATION : Dendreon Announces Marketing Authorization …
@Wolf, tutto è possibile. $MACK mi pare avere una fase 3 poco convincente in corso ed diverse indicazioni in fase 2 per un anticorpo bispecifico che finora a dato adito a poche speranze… ma siccome tendo a confondere i BsAbs di $EBS con quelli di $MACK, è meglio se vado a riguardarli con attenzione…
@Paolo, dati della fase 2 del loro vaccino in pazienti con GBM di nuova diagnosi:
Agenus Inc. (NAS: AGEN) today announced that a recent analysis from a Phase 2 trial in patients with newly diagnosed glioblastoma multiforme (GBM) treated with Prophage Series G-100 (HSPPC-96) in combination with the current standard of care (radiation and temozolomide) showed an almost 18 month median progression free survival (PFS), which represents a 160% increase versus current standard of care alone. This analysis confirms continuation of the positive trends from the Phase 2 HSPPC-96 newly diagnosed GBM trial first reported at the 81st American Association of Neurological Surgeons (AANS) Annual Scientific Meeting in May 2013.
Dati poco chiari e (secondo me) non impressionanti… da approfondire comunque e potrebbe scapparci un articolo, magari metto insieme $MACK per Wolf
Anche su mack opinioni grazie! Tornerà mai a 6 dollari?
duca conte CK ma AGEN me la guardi che fa +22% in pre con 100K pz
@Malines, copyright issues… i need a lawyer… no shame, no heart & no moral
CK is not Calvin Klein, is Cereal Killer