Array ieri ha comunicato sia l’intenzione di iniziare una nuova fase 3 di MEK 162 sia i conti. Il risultato? Il risultato è che ho fatto bene a vendere in parte il titolo attorno ai 6,5 dollari. Cosa c’è dietro a questo calo? L’accordo con Novartis sta inducendo Array a fare scelte che il mercato punisce aspramente e anche in questa occasione a farne le spese sono gli azionisti. Chi ha ragione, il mercato od Array?
Andiamo con ordine. Iniziamo dai conti, visto che anche quelli sono stati rilasciati in occasione dell’annuncio della fase 3.
I ricavi al 31 marzo 2013 sono stati di 10 milioni di dollari, contro i 19,1 dello stesso periodo del 2012, differenza che si fa segnare esclusivamente in relazione a milestones di Amgene e Genentech che non si sono ripetute quest’anno. Spese R&D 15,1 milioni, un milione meno dell’anno passato. Perdita netta 21,6 milioni (-0.19 dollari ad azione) per il terzo trimestre contro 8,2 milioni (-0,11 ad azione) nello stesso periodo targato 2012. Array reitera la convinzione di terminare l’anno fiscale a giugno con 60 milioni in ricavi ed ha precisato di aver terminato il trimestre con 87 milioni in cassa ed equivalenti.
Archiviata la pratica contabile vediamo l’altra notizia, ossia l’inizio di uno studio potenzialmente registrativo per MEK 162 a conduzione “casalinga”, se mi passate il termine. Ecco quanto affermato nella PR:
Array BioPharma Inc. (NASDAQ: ARRY) today announced that it will initiate a global Phase 3 clinical trial in patients with recurrent low-grade serous ovarian cancer (LGSOC) during the summer of 2013. The study, called MILO (MEK Inhibitor in Low Grade Serous Ovarian Cancer), will evaluate the efficacy and safety of MEK162 compared to standard chemotherapy treatments and is designed for worldwide regulatory submissions, including with the U.S. Food and Drug Administration and the European Medicines Agency. Array invented MEK162 and licensed worldwide rights to develop and commercialize the drug to Novartis in April 2010. The MILO study follows a recent announcement by Novartis detailing plans to initiate Phase 3 trials of MEK162 in both NRAS- and BRAF-mutant melanoma and will be covered as part of the Novartis/Array co-development agreement under which costs are capped annually and in total for Array.
La fase 3 che Array inizierà si chiamerà MILO (MEK Inhibitor in Low Grade Serous Ovarian Cancer) e partirà in estate e vedrà investigato MEK 162 rispetto a terapie a scelta degli investigatori su circa 300 pazienti con LGSOC (carcinoma ovarico sieroso di baso grado, per gli anglofoni Low Grade Serous Ovarian Cancer).
“We have seen encouraging early clinical results using a MEK inhibitor in patients with recurrent low-grade serous cancer when compared to the historic data of cytotoxic chemotherapy, the current standard of care,” said Bradley J. Monk, MD, Director of the Division of Gynecologic Oncology at the University of Arizona Cancer Center at St. Joseph’s Hospital in Phoenix and at the Creighton University School of Medicine. “There remains a significant unmet medical need for effective treatment in low-grade serous ovarian cancer and I look forward to investigating MEK162 in this Phase 3 study.”
I pazienti arruolabili dovrebbero essere affetti da LGSOC ricorrente o persistente che siano già stati trattati con almeno una linea terapeutica a base di platino e non più di tre linee di trattamento basate su chemio tradizionale. Endpoint primario la progressione libera da malattia (PFS), secondario la sopravvivenza globale (OS).
La sfida è tutt’altro che semplice vista la natura del male e la scelta di puntare su pazienti già trattati, ma il razionale dietro a questo studio è interessante. A rendere poi il tutto ancora più interessante è il fatto che buona parte dell’utilità dei MEKi in questa indicazione l’ha fornita l’altro prodotto di Array: selumetinib.
I dati sono stati pubblicati a febbraio da The Lancet Oncology ma Array li aveva già presentati all’AACR 2012 e riguardano Selumetinib impiegato in una fase 2 condotta dal GOG, il Gynecologic Oncology Group.
In questo studio 52 pazienti con LGSOC ricorrente sono stati trattati con 50mg di selumetinib due volte al giorno in cicli da 4 settimane fino alla progressione della malattia o tossicità elevata. Il 58% dei soggetti aveva ricevuto 3 o più regimi di chemioterapia, quindi si parla di soggetti maggiormente trattati rispetto a quelli che verranno arruolati in MILO. Il taso di controllo della malattia fatto registrare dal farmaco di Array è stato dell’81% ed ha visto una paziente ottenere una risposta completa e 7 una parziale. A questo va aggiunto che 34 pazienti (il 65%) ha sperimentato una progressione libera da malattia superiore a 6 mesi con una PFS mediana di 11 mesi mentre al sopravvivenza a due anni è stata del 55%. Ancora mancano dati sulla sopravvivenza mediana perché al cut-off per le analisi il 61% delle pazienti era ancora in vita.
Dei 55 pazienti arruolati, 22 hanno visto ridurre il dosaggio del farmaco e 13 hanno dovuto abbandonare lo studio a causa degli eventi avversi, tuttavia nessuna morte è stata attribuita al farmaco. Il drop-out dello studio è abbastanza elevato, ma se si considera la scarsità di opzioni efficaci, mi pare giustificabile.
Ha quindi senso da parte di Array perseguire una simile indicazione anche con MEK 162?
Array, la rincorsa a Novartis a spese degli azionisti?
Se mi seguite su Array fin dall’inizio dell’avventura nel portafoglio virtuale, quando cioè si stava ancora a quota 2 dollari e rotti, sapete come la penso sia su selumetinib che su MEK 162, sia sulla compagnia in generale. Array non molto tempo fa ha annunciato una shelf registration che le assicura la possibilità di emettere azioni per un valore di 75 milioni di dollari da qui fino al 27 marzo 2016. Nell’articolo in cui parlavo di quel fatto, che causò un crollo del 10% del titolo in after hour, avevo già anticipato l’evento che si è concretizzato ieri, ossia l’intenzione di iniziare MILO in estate. Ovviamente, non conoscevo i dettagli dello studio, ma il tutto rientra nella strategia di Array che vi avevo anticipato, pagare un contributo a Novartis (in termini di ricerca e anche monetari) per mantenere al livello più alto possibile il ricavo dalle future vendite di MEK 162.
La strategia mi pare quindi giusta. La scelta dello studio, francamente no.
Assumendo che Selumetinib e MEK 162 abbiano un grado di efficacia paragonabile, i dati di maggior interesse sono legati a mutazioni BRAF, NRAS, per cui sono in partenza due fasi 3 sponsorizzate da Novartis con MEK 162 in soggetti affetti da melanoma, e KRAS per la quale Astra Zeneca inizierà una fase 3 nel carcinoma polmonare a breve.

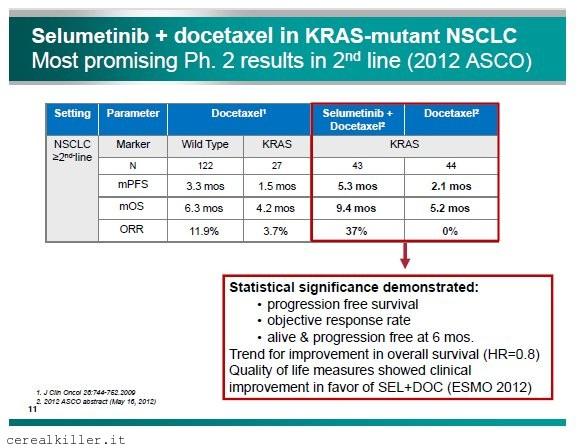
Dati presentati ad ASCO12 di selumetinib nel trattamento del tumore al polmone in pazienti con mutazione KRAS. Impressionanti sia la progressione libera da malattia (PFS) sia la sopravvivenza globale (OS).
Sempre a proposito di Selumetinib, oltre ai dati stellari presentati ad ASCO12 riguardo il umore al polmone, non molto tempo fa vi ho raccontato di una fase 3 in partenza riguardo il trattamento di pazienti con carcinoma della tiroide refrattari all’ablazione con radioiodio. La convinzione che Selumetinib sia utile si basa sul fatto la capacità delle cellule di assorbire radiazioni è controllata dal MAPK, da qui l’utilità di un MEK inibitore. I dati sperimentali poi hanno mostrato un netto beneficio in soggetti con mutazione del gene RAS, il che è perfettamente in linea con quello che sappiamo sia di Selumetinib che di MEK 162:
Dei pazienti valutabili, sono stati 12 quelli in cui il livello di assorbimento di iodio 124 è aumentato e fra questi 5 pazienti con mutazione NRAS e 4 con mutazione a livello del gene BRAF (su 9 BRAF mutati totali). In 8 pazienti (inclusi tutti e 5 con mutazione del gene NRAS) selumetinib ha permesso di proseguire con la terapia di ablazione. In seguito alla RAI si sono registrate 5 risposte parziali (PR) confermate e 3 stabilizzazioni della malattia (SD) e per 7 di loro la situazione è rimasta invariata nel corso dei 6 mesi di follow up. In tutti e otto i pazienti si è assistito ad un decremento dei livelli di tireoglobulina, marker tumorale per verificare l’andamento delle terapie nel cancro alla tiroide, per un valore mediano dell’89%.
Novartis ha scelto di impiegare MEK 162 in due studi che fanno uso di biomarker per definire i pazienti che meglio risponderanno al trattamento, Array per la sua fase 3 evidentemente no.
Ritorniamo a Selumetinib ed al LGSOC.
Sebbene dei 55 pazienti solo 34 abbiano fornico campioni sufficienti per un’analisi dei biomarker, sappiamo che 14 avevano mutazione KRAS e due BRAF. 16 pazienti con mutazioni nelle quali ci si aspetterebbe che selumetinib mostri efficacia su un totale di 34 campioni significa poco meno del 50% dei pazienti valutabili, percentuale che possiamo assumere corretta per l’intera popolazione ITT. Nessun beneficio dall’impiego di Selumetinib è stato correlato alle varie mutazioni.
Questo tende a farmi pensare che un criterio di inclusione possibile vada a farsi benedire. Chiedo scusa per il tecnicismo.
Selumetinib ha ottenuto un tasso di risposta elevato e benché lo studio non contenesse un braccio di controllo tuttavia i dati relativi a 58 donne trattate nel centro in cui la sperimentazione è avvenuta mostrano un tasso del 3,7%, frutto di una risposta completa e di 3 risposte parziali. I paragoni con la storia però, non portano lontano.
Non cambia il mio giudizio sulla compagnia ma, sebbene la reazione possa essere esagerata o sembrare tale, quest’ultima mossa non mi è piaciuta.
Abbiamo uno studio registrativo impostato sulle evidenze di un’altro farmaco, in una indicazione complicata e senza impiego di biomarker.
Una scelta coraggiosa. Coraggiosa ma senza senso, secondo me.
Vi ho già detto in passato che ritengo che sia Novartis (ed è comprensibile) sia Array ritengano MEK 162 superiore a Selumetinib. Chiaramente, è solo la mia opinione, ma ritengo sia estremamente plausibile. In base a questa logica il rischio di Array nel LGSOC assume connotazioni migliori? Ancora una volta la mia risposta è no. Mettiamo che siano solo allo stesso livello di efficacia, non avrebbe avuto più senso una fase 3 direttamente contro AstraZeneca nel tumore al polmone KRAS+?
ARRY si muove 😉
vi segnalo, per chi nn lo sapesse , uscito articolo su seeking alfa
http://seekingalpha.com/article/1428191-part-2-will-array-biopharma-become-a-late-stage-biopharmaceutical-company?source=google_news
ciao
In effetti pensavo a tutt’altro… 🙂
Armi belliche, scrivi? Non pensare a comuni armi in dotazione agli eserciti meglio equipaggiati……
😀
@Elisa, grazie del sostegno psicologico e bellico. Luciano sostiene una posizione alquanto interessante, anche se con modi poco educati e giungendo ad una conclusione che non mi trova affatto concorde. Magari un giorno ci scriverò su…
si ma quindi se ho capito bene niente donne in abiti succinti in questo blog ? eppure in passato c’era tanta abbondanza di carne qui !!! 🙂
Vedi di non apostrofare con epiteti meno che garbati il mio e di tanti amico, altrimenti te la dovrai vedere con me. Sono stata sufficientemente chiara? >_<
Luciano, tanto per cominciare, se l’aggettivo “schifoso” è riferito a me, avresti dovuto mettere una virgola. Così:
“hai cancellato il mio messaggio, schifoso”
Inoltre, per tua conoscenza, non cancello i commenti. C’è un plug-in (un’applicazione, se preferisci) che mi consente di non dover intervenire manualmente ogni volta che qualche gentleman come te si fa vivo riempiendomi di “attenzioni”.
Nel caso specifico però, più che gli insulti, sono stati i link che hai messo a far finire il tuo commento nello spam (io poi l’ho cestinato, comunque…). Akismet blocca i commenti con un numero elevato di link, visto che di solito sono messaggi di spam.
Mistero risolto, solo una questione di filtri.
Hai cancellato il mio messaggio schifoso
Minerale, in bocca al lupo!
Ieri ingresso in DCTH a 0,44, punto ad uscita lampo, vediamo se ci prendo…
@Luca, dita incrociate! 😉 @Diego, ciao! Ho dato uno sguardo di sfuggita alla CC e, sebbene alcuni passaggi non mi siano chiari, mi pare che i dati non siano sorprendenti, ne in positivo ne in negativo. Non è che ci capisca molto di questioni economiche, ma la curva relativa ai guadagni nelle prime fasi del lancio di un farmaco è una salita piuttosto ripida, specialmente quando si deve approntare una forza vendite e non si conta su un partner. Come ti dicevo ieri, mi pare presto per commentare i dati di vendita… serve almeno un’altro punto da mettere sul grafico…
Ciao Alessio! Non sono propriamente un ammiratore di cyclacel e nello specifico dello studio che hai postato faccio fatica ad esprimermi, vista la mancanza di dati credibili per quell’indicazione e quella linea terapeutica. I numeri sono buoni, se confrontati con la letteratura, ma lo studio è open label e senza braccio di controllo, lo scopo è quello di identificare il dosaggio e la somministrazione migliore, anche se ovviamente il tutto è misurato in base all’efficacia del farmaco. 9 mesi rispetto ai 5 che credo possano essere considerati un dato accettabile come confronto sono un evidente miglioramento, da qui in poi però mi fermerei. per me sono due le ipotesi di investimento… adesso in ottica speculativa, ma con occhio alle scadenze (in particolare la fase 3, non so a che punto sta)… o più avanti… puntando sul ribasso (mia opinione, la fase 3 fallirà ed anche in modo pesante). il resto della pipeline potrebbe riservare qualche sorpresa… ma va approfondito il discorso
ciao cereal sono usciti i dati cosa ne pensi?
MHHH…..speriamo che la stiano preparando per un bel JUMP in vista di ASCO…
evento binario si spera! 😉 🙂
OFF TOPIC, qualcuno ha un parere su CYCC? vorrei rientrare, si è abbassata molto, ha 16m in cash ma burn rate di 1,3M quindi per un altro annetto sta benone.
http://finance.yahoo.com/news/cyclacel-reports-updated-phase-2-110000300.html
che ne pensate?
Amarin sempre peggio ormai anche i ricercatori italiani cercano di affossare l’olio di pesce !!
http://www.forbes.com/sites/larryhusten/2013/05/08/another-disappointing-study-for-fish-oil-supplements/?partner=yahootix
Ciao Diego, penso che tutto quello che può andar male per $AMRN stia andando… molto male. Un periodo decisamente brutto che può essere cancellato solo vendendo Vascepa. Ad aggiungersi a quanto di negativo aleggia sulla compagnia poi ci si mettono anche i dubbi sollevati dall’articolo del NEJM in merito ai presunti benefici dei supplementi a base di olio di pesce. Mi chiedo se sia normale che salti fuori tutto adesso… 😉
In bocca al lupo per le vendite, non so se qualcosa si sa già in merito alle prescrizioni, ma mi pare presto per trarre delle conclusioni… tuttavia il mercato di solito non ha pazienza.
Il mio pensiero sulla compagnia non è cambiato di molto… vascepa è superiore a lovaza e la questione NCE è ridicola… tutti quelli che erano spaventati dal fatto che ci fossero pochi brevetti a protezione della proprietà intellettuale del farmaco sono spariti… adesso che questa si rafforza ogni giorno che passa. Ridicolo, davvero ridicolo.
ciao cereal stasera i dati di amarin cosa pensi al momento sul titolo?
Figurati, ci mancherebbe…
Si giusto grazie! prezioso come sempre
Attento, stai facendo confusione fra l’obiettivo dello studio (che ribadisco essere la progressione libera da malattia o PFS) e la potenza dello studio… il 60% che hai citato non ha nulla a che vedere con l’endpoint primario ma con la capacità (tra parentesi un po’ bassa) di dimostrare superiorità a livello statistico del farmaco rispetto al controllo.
Mi riferivo a questa frase emersa durante la conference:
the study is powered roughly to show a 60% improvement in progression free survival
Non è quello l’obiettivo dello studio, l’obiettivo è semlicemente la progressione libera da malattia
Andrea non pensi che l’obiettivo del trial MILO del 60% nella sopravvivenza libera da progressione sia alquanto ambizioso?
Il melanoma per selumetinib è rischioso, ma tanto intrigante… forse AstraZeneca non è il partner giusto, ma quello è. $CRIS sarà una delle più interessanti da tenere d’occhio ad ASCO13, $EXEL ha un valore aggiunto dato dall’approvazione di cometriq che non si può ancora quantificare ma a mio avviso la partnership con Roche non è ancora stata apprezzata a dovere dal mercato.
infatti, basterebbe un bel abstract…..oltre i massimi eh.
intanto anche cris….bel candelotto di 300k.
su exel ero tentato di uscire ma visto il rimbalzo tengo.
@Luca, vero, ma la legge dei grandi numeri ci insegna che più fasi 3 si iniziano e maggiori sono le possibilità che una di queste sia sceltain base a criteri demenziali.
@Simon, grazie. Il gap di può chiudere di certo, fino a non molto tempo fa solo superare quota 5 dollari sembrava difficile, poi abbiamo supportato anche i6$…
Grandissimo ck
E’ anche vero che le altre fasi 3 sono forse piu’ importanti….questo gap dai massimi di capitalizz puo’ essere facilmente colmato
Grazie CK,
mi chiedo comunque una cosa.. visto il Management team e il board, saranno mica dei pazzi fuoriosi?! se hanno fatto questa scelta avranno avuto i loro buoni motivi si spera!
ti saluto e ti lascio con un passaggio di un tuo articolo:
Se Array, che di sicuro conosce bene il farmaco, ha deciso di dare priorità all’altro MEK inibitore nonostante selumetinib abbia così tanto potenziale, come ha mostrato e come continua a fare tuttora, mi vien da pensare che MEK 162 sia ancora meglio…
@Simon, il giudizio nel breve su $ARRY non cambia, ma se qualcuno si stesse chiedendo come un’azienda con farmaci così promettenti capitalizzi così poco, parte delle risposte stanno in scelte come quella fatta sulla fase 3 da intraprendere. Si, abstract settimana prossima (la maggior parte) e interesse alto per selumetinib nel melanoma. Grande rischio, ma di impatto limitato rispetto a quanto già fatto vedere in molte altre indicazioni…
@Claudio, il rischio di nuove emissioni non è aumentato, rimane sempre lo stesso. Discuto la scelta, non tanto la politica economica. Per quello ritengo che $ARRY, così come altre aziende, si sia $EXELizzata… quindi non mi stupisco più di nulla. Certo è che se la facessero come l’ultima volta, a prezzi più che “popolari”… non la prenderei benissimo.
Rischio che facciano un aumento di capitale???
quindi cosa si fa? si bacchetta arry oppure diamo fiducia fino ad asco?? settimana prossima con gli abstract??