Achillion lascia il 20% in after, sulla comunicazione dello stop imposto da FDA riguardo uno studio nel quale è coinvolto uno dei principali candidati della compagnia nell’ambito del programma sul trattamento dell’epatite C. Ora, prima di entrare nel merito della questione, vorrei anticipare una considerazione che credo sia doverosa. FDA ha comunicato ad Achillion la decisione il 28 giugno, Achillion lo ha reso noto ieri a mercati chiusi. C’è voluto un intero weekend per buttar giù una press release?
Eccola:
Gli elementi importanti sono che in uno studio relativo all’interazione fra farmaci riguardante sovaprevir si è riscontrato un aumento dei valori enzimatici del fegato in concomitanza dell’impiego di atazanivir. La fase 2 attualmente in corso che vede impegnato sovaprevir, ACH 3102 e ribavirin tuttavia può continuare senza problemi, il che mette lo stop in un contesto meno drammatico di quanto si potesse pensare all’inizio. Durante la fase 1 incriminata Achillion si accorge che in diversi soggetti si verifica un aumento di transaminasi di un certo grado, ma non sufficientemente pronunciato perché il fenomeno possa essere classificato come evento avverso grave. Achillion ferma tutto ed avvisa FDA. E’ importante considerare che assieme ai dati dello studio di interazione Achillion ha sottoposto ad FDA anche i dati relativi allo studio di sovaprevir, ACH 3102 e ribavirina, quindi FDA non si è limitata a consentire il proseguimento della fase 2 solo sulla base di considerazioni teoriche, ha verificato i dati disponibili.
I dati dello studio a 6 settimane, laddove disponibili, non mostrano significativi aumenti di transaminasi nei pazienti arruolati. Non è finita. Achillion ha condotto altri studi di interazione di quali è emerso che sovaprevir non causa problemi degli di nota se impiegato, ad esempio, con contraccettivi, metadone, midazolan e, cosa fondamentale, ACH 3102.
Non sto certo dicendo che la notizia non abbia risvolti negativi, sia chiaro. Uno dei punti di forza di sovaprevir era considerato il profilo di sicurezza, in particolare per quanto concerne l’interazione con altri farmaci, convinzione che ora viene minata in parte. Il punto è cercare di stabilire se il 20% perso in after rappresenti un prezzo troppo alto da pagare per la compagnia a fronte di uno stop che non riguarda uno studio chiave.
A mio modo di vedere questa notizia potrebbe costituire una buona occasione per un ingresso. La quotazione raggiunta in after è inferiore a quella del dopo emissione dello scorso febbraio e tutti gli obiettivi della compagnia sono rimasti immutati, sia come progetto di sviluppo che come tempistica.
La fase 2 impiega sovaprevir in due dosaggi (200 e 400 mg) assieme ad ACH 3102 e ribavirina e l’arruolamento nei 3 bracci è sufficientemente avanzato da far ipotizzare che se qualche problema di sicurezza ci fosse, sarebbe emerso.
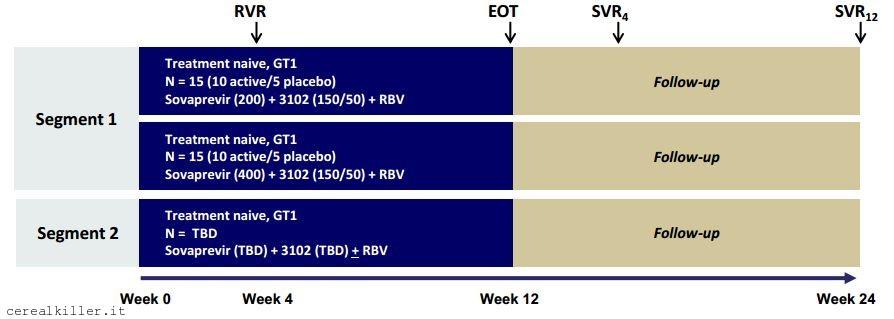
Come vedete dall’immagine lo studio -007, cioè la fase 2 che vede sovaprevir con ACH 3102 e ribavirina è suddivisa in due segmenti, in modo da valutare anche il regime senza ribavirina. Vediamo come questo si rapporta allo studio sull’interazione dei farmaci (DDI, drug-drug interaction). Lo studio DDI è composto da tre fasi e nel caso che ci interessa la prima fase ha visto la somministrazione in monoterapia di atazanavir, nella seconda il solo sovaprevir e nella terza tutti e due. Ogni fase dura 2 settimane con un periodo di wash-out di almeno 5 giorni fra una fase e l’altra. Nella prima e nella seconda fase non si è assistito a nessun aumento di transaminasi, cosa che invece è accaduto nella terza fase, quella con i farmaci dati in combo. Come detto gli eventi avversi non sono caratterizzabili come gravi e risultano essere transitori, con valori che tornano ai livelli dell’ingresso allo studio dopo che i farmaci non vengono somministrati. In totale su 31 soggetti si sono riscontrati 2 casi di aumento dei livelli di ALT di grado 4 e 3 casi di grado 3.
Quello che è chiaro è che se evento avverso ci deve essere, a livello di interazioni di farmaci, questo è quasi immediato. Achillion sostiene di aver riscontrato l’abnorme aumento di ALT alla fine del periodo di combinazione, il che significa due settimane scarse. Non mi aspetto un simile inconveniente nello studio 007, ma andiamo a vedere quali sono i dettagli relativi al profilo di sicurezza del farmaco. Sovaprevir è stato testato su circa 400 soggetti, tra volontari sani e malati, senza destare particolari dubbi circa la sicurezza del farmaco per periodi fino 12 settimane, a dosaggi di 200, 400 e 800 mg. FDA ha dato il via libera ai due dosaggi inferiori per la fase 2. L’aumento di transaminasi si è verificato su soggetti trattati con una formulazione a 300 mg e l’uso concomitante di atazanavir. Se una simile condizione potesse verificarsi nello studio 007, ci sarebbero state avvisaglie in passato.
Ma anche il presente dovrebbe essere di conforto, visto che finora nessun tipo di alterazione si è riscontrata nello studio 007, che infatti ha il permesso da parte di FDA di continuare immutato.
I dati ad interim della fase 2 sono attesi per il terzo trimestre di quest’anno, il che assomigli a moto ad un evento binario…
Ricapitolando, Achillion in uno studio riguardo l’interazione con atanazavir ha riscontrato delle anomalie, ha terminato lo studio ed ha avvisato FDA. FDA da il via libera alla fase 2 in corso in base ai dati forniti dalla compagnia e piazza un “hold” ad uno studio già fermo. A questo punto, la domanda lecita è la seguente: cosa ha realmente bloccato FDA? La risposta: assolutamente nulla.

Grazie!!
Beh, evento binario, battuto cassa & intrigante ADC. Se non avessi perso tempo avrei portato a termine l’ingresso in $STML, ma pazienza…
CK
dei tanti titoli di cui hai parlato, solo progenics ti ha spinto ad acquistare…..pucche????
Simon, vedi di accontentarti….. >_<
achn
non ancora! aspetto un ultimo affondo, se arriva. Ma forse dovrei accontentarmi, e poi c’e’ ziop e stml che mi fanno inkazz….
http://it.wikipedia.org/wiki/File:Leon_Benouville_The_Wrath_of_Achilles.jpg
La furia di ACHILLion…..suonino le tromme, rullino i tamburi!!!
ALLA RISCOSSAAAAAAAAAAAAAAAAAA!!!!!!!!!!!
ACHILLion, fai proprio schifo……… >_<
Miagolano tutt’e due, ma di fusa non ne fanno………
Quello che fa le fusa… e con questa… direi che la mia bella figura quotidiana l’ho fatta!
Ne ho giusto due in scala 1:5, uno di porfido rosso e uno di onice verde. Tu quale sei? 😀
@Elisa, io sono un gatto di marmo…
@Simon, se le hai preso $ACHN in chiusura hai fatto una mossa saggia IMHO
@Malines, per $ACHN? Ti starai consolando con $ARIA, no?
Bad Day. Very Bad.
mi tenta anche stml…..ok spengo il pc
liquido appy e tento un ingresso per un bel rimbalzo…..
Non son mica tutti veloci come te! 😛